CDE一口气发布23份技术指南!《灭菌和无菌工艺研究及验证指导原则》正式实施!
元旦前夕,国家药监局审评中心发布了23份文件,如下:
化学药品注射剂灭菌和无菌工艺研究及验证指导原则(试行)
治疗脂代谢紊乱药物临床试验技术指导原则
单纯性尿路感染抗菌药物临床试验技术指导原则
复杂性尿路感染抗菌药物临床试验技术指导原则
医院获得性细菌性肺炎呼吸机相关细菌性肺炎抗菌药物临床试验技术指导原则
抗肺结核药物临床试验技术指导原则
抗菌药物临床试验微生物学实验技术指导原则
儿科用药临床药理学研究技术指导原则
儿童用药(化学药品)药学开发指导原则(试行)
抗肿瘤创新药上市申请安全性总结资料准备技术指导原则
化学药品改良型新药临床试验技术指导原则
药物临床试验多重性问题指导原则(试行)
药物临床试验协变量校正指导原则
药物临床试验亚组分析指导原则(试行)
群体药代动力学研究技术指导原则
窄治疗指数药物生物等效性研究技术指导原则
抗肿瘤药物临床试验统计学设计指导原则(试行)
药物临床试验富集策略与设计指导原则(试行)
模型引导的药物研发技术指导原则
抗肿瘤药联合治疗临床试验技术指导原则
中药新药用于慢性便秘临床研究技术指导原则中药新药用于糖尿病肾脏疾病临床研究技术指导原则
关于开通使用国家药监局网上办事大厅统一登录入口的通知
药品审评审批信息公开管理办法
实施日期如下:
文件名称 |
发布日期 |
实施日期 |
化学药品注射剂灭菌和无菌工艺研究及验证指导原则(试行) |
2020年12月1日 |
2020年12月1日 |
治疗脂代谢紊乱药物临床试验技术指导原则 |
2020年12月1日 |
2020年12月1日 |
单纯性尿路感染抗菌药物临床试验技术指导原则 |
2020年12月1日 |
2020年12月1日 |
复杂性尿路感染抗菌药物临床试验技术指导原则 |
2020年12月1日 |
2020年12月1日 |
医院获得性细菌性肺炎呼吸机相关细菌性肺炎抗菌药物临床试验技术指导原则 |
2020年12月1日 |
2020年12月1日 |
抗肺结核药物临床试验技术指导原则 |
2020年12月1日 |
2020年12月1日 |
抗菌药物临床试验微生物学实验技术指导原则 |
2020年12月1日 |
2020年12月1日 |
儿科用药临床药理学研究技术指导原则 |
2020年12月1日 |
2020年12月1日 |
儿童用药(化学药品)药学开发指导原则(试行) |
2020年12月1日 |
2020年12月1日 |
抗肿瘤创新药上市申请安全性总结资料准备技术指导原则 |
2020年12月1日 |
2020年12月1日 |
化学药品改良型新药临床试验技术指导原则 |
2020年12月1日 |
2020年12月1日 |
药物临床试验多重性问题指导原则(试行) |
2020年12月1日 |
2020年12月1日 |
药物临床试验协变量校正指导原则 |
2020年12月1日 |
2020年12月1日 |
药物临床试验亚组分析指导原则(试行) |
2020年12月1日 |
2020年12月1日 |
群体药代动力学研究技术指导原则 |
2020年12月1日 |
2020年12月1日 |
窄治疗指数药物生物等效性研究技术指导原则 |
2020年12月1日 |
2020年12月1日 |
抗肿瘤药物临床试验统计学设计指导原则(试行) |
2020年12月1日 |
2020年12月1日 |
药物临床试验富集策略与设计指导原则(试行) |
2020年12月1日 |
2020年12月1日 |
模型引导的药物研发技术指导原则 |
2020年12月1日 |
2020年12月1日 |
抗肿瘤药联合治疗临床试验技术指导原则 |
2020年12月1日 |
2020年12月1日 |
中药新药用于慢性便秘临床研究技术指导原则中药新药用于糖尿病肾脏疾病临床研究技术指导原则 |
2020年12月1日 |
2020年12月1日 |
关于开通使用国家药监局网上办事大厅统一登录入口的通知 |
2020年12月1日 |
—— |
药品审评审批信息公开管理办法 |
2020年12月2日 |
2021年6月1日 |
化学药品注射剂灭菌和无菌工艺研究及验证指导原则(试行)
目录
一、概述
二、注射剂湿热灭菌工艺
(一)湿热灭菌工艺的研究
1.湿热灭菌工艺的确定依据
2.微生物污染的监控
(二)湿热灭菌工艺的验证
1.物理确认
2.生物学确认
3.基于风险评估的验证方案设计
三、注射剂无菌生产工艺
(一)无菌生产工艺的研究
1.除菌过滤工艺的研究
2.无菌分装工艺的研究
(二)无菌生产工艺的验证
1.除菌过滤工艺验证
2.无菌工艺模拟试验
四、附件
五、参考文献
一、概述
无菌药品是指法定药品标准中列有无菌检查项目的制剂和原料药,一般包括注射剂、无菌原料药及滴眼剂等。从严格意义上讲,无菌药品应不含任何活的微生物,但由于目前检验手段的局限性,绝对无菌的概念不能适用于对整批产品的无菌性评价,因此目前所使用的“无菌”概念,是概率意义上的“无菌”。特定批次药品的无菌特性只能通过该批药品中活微生物存在的概率低至某个可接受的水平,即无菌保证水平(Sterility Assurance Level, SAL)来表征,而这种概率意义上的无菌需通过合理设计和全面验证的灭菌/除菌工艺过程、良好的无菌保证体系以及在生产过程中严格执行药品生产质量管理规范(GMP)予以保证。
本指导原则主要参考国内外相关技术指导原则和标准起草制订,重点对注射剂常用的灭菌/无菌工艺,即湿热灭菌为主的最终灭菌工艺(Terminal Sterilization Process)和无菌生产工艺(Aseptic Process)的研究和验证进行阐述,旨在促进现阶段化学药品注射剂的研究和评价工作的开展。本指导原则主要适用于注射剂申请上市以及上市后变更等注册申报过程中对灭菌/无菌工艺进行的研究和验证工作,相关仪器设备等的验证及常规再验证不包括在本指导原则的范围内。
本指导原则的起草是基于对该问题的当前认知,随着相关法规的不断完善以及药物研究技术要求的提高,本技术指南将不断修订并完善。
二、注射剂湿热灭菌工艺
(一)湿热灭菌工艺的研究
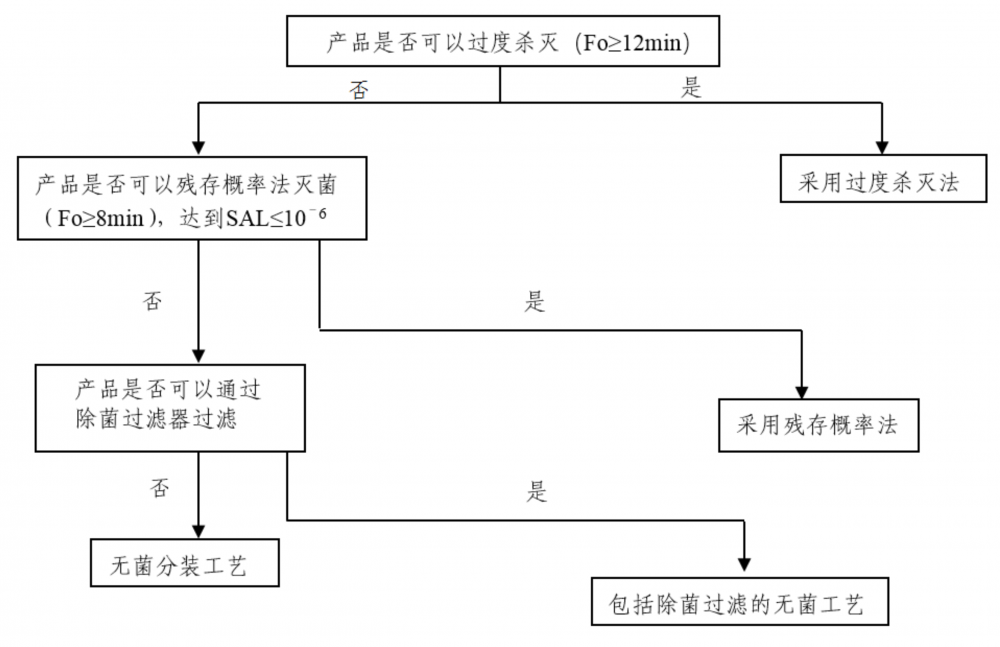
1.湿热灭菌工艺的确定依据灭菌工艺的选择一般按照灭菌工艺选择的决策树(详见附件 1)进行,湿热灭菌工艺是决策树中首先考虑的灭菌方法。湿热灭菌法系指将物品置于灭菌设备内利用饱和蒸汽、蒸汽-空气混合物、蒸汽-空气-水混合物、过热水等手段使微生物菌体中的蛋内质、核酸发生变性而杀灭微生物的方法。
注射剂的湿热灭菌工艺应首选过度杀灭法,即 F0(标准灭菌时间)值大于等于 12 分钟的灭菌工艺;对热不稳定的药物,可以选择残存概率法,即 F0 值大于等于 8 分钟的灭菌工艺。如果 F0 值不能达到 8 分钟,提示选择湿热灭菌工艺不合适,需要考虑无菌生产工艺。
以上两种湿热灭菌工艺都可以在实际生产中使用,具体选择哪种灭菌工艺,在很大程度上取决于产品的热稳定性。药物是否能耐受湿热灭菌工艺,除了与药物活性成分的化学性质相关外,还与制剂的处方、工艺、包装容器等密切相关,所以在初期的工艺设计过程中需要通过对药物热稳定性的综合分析来确定湿热灭菌工艺的可行性。
一般而言,需要通过各个方面的研究,使药物尽可能地可以采用湿热灭菌工艺。只有在理论和实践均证明即使采用了各种可行的技术方法之后,药物活性成分依然无法耐受湿热灭菌工艺时,才能选择无菌生产工艺。任何商业上的考虑均不能作为不采用具有最高无菌保证水平的最终灭菌工艺的理由。
1.1 药物活性成分的化学结构特点与稳定性
通过对药物活性成分的化学结构进行分析,可以初步判断药物活性成分的稳定性,如果其结构中含有一些对热不稳定的化学基团,则提示该药物活性成分的热稳定性可能较差。在此基础之上,还应该通过设计一系列的强制降解试验对药物活性成分的稳定性做进一步研究确认,了解在各种条件下可能发生的降解反应,以便在处方工艺研究中采取针对性的措施,保障产品能够采用湿热灭菌工艺。对于一般降解杂质,不应仅仅因为其含量超过 ICHQ3A、Q3B 指导原则规定的限度,就排除湿热灭菌工艺而不进行论证,如果一般降解杂质确证为代谢产物或其含量水平已经过确认在可接受的范围内,仍推荐采用湿热灭菌工艺。
1.2 处方工艺
在对药物活性成分的化学结构特点与稳定性进行研究的基础上,可以有针对性地进行处方工艺的优化研究。例如采用充氮工艺或在处方中加入适宜的抗氧化剂来减少氧化杂质的产生;选择利于药物活性成分稳定的 pH 值范围、溶剂系统、辅料等;通过灭菌时间和灭菌温度的调整来筛选药物活性成分可以耐受的湿热灭菌工艺条件等。
1.3 包装系统
注射剂包装系统的选择和设计也是可能影响湿热灭菌工艺条件选择和最终无菌保证水平的重要因素。研究中需要结合产品特性、包装系统的相容性、以及灭菌器的灭菌原理等,对包装系统的种类、性状、尺寸进行筛选,保证所选的灭菌工艺条件不会对包装系统的密封性和相容性产生不利的影响,如包装系统的变形、破裂,或者浸出物超过可接受的水平等。应该注意的是,使用热不稳定的包装系统不能作为选择无菌工艺的理由。
1.4 注射剂的稳定性研究
无论使用何种设计方法,都需要进行最终灭菌产品的稳定性研究。考察最终灭菌工艺对产品稳定性影响的指标可包括有关物质、含量、pH 值、颜色以及产品的其它关键质量属性。
灭菌时,微生物的杀灭效果和药物活性成分的降解程度都是温度和时间累积作用的结果。这意味着加热和冷却过程的变化也可能影响微生物的杀灭效果和产品的稳定性。因此,稳定性研究用样品最好选取处于最苛刻灭菌条件下的产品,如可选取在热穿透试验中 F0 最大或灭菌参数值(最高允许灭菌温度和/或最长灭菌时间)最大位置处的灭菌产品进行稳定性考察,以确保产品的质量在有效期内仍能符合要求。
1.5 仿制注射剂灭菌工艺的选择
仿制注射剂选择的灭菌/除菌工艺,应能保证其无菌保证水平不低于参比制剂。如果参比制剂采用了无菌生产工艺,若仿制注射剂对其处方组成合理性、灭菌工艺产生的降解杂质等风险因素进行了全面的论证之后,也应按照灭菌工艺选择的决策树(详见附件 1)进行灭菌工艺的选择。
2.微生物污染的监控
湿热灭菌工艺的灭菌温度和时间通常会对微生物,尤其耐受性较大的微生物的杀灭效果产生影响。过度杀灭法假设的微生物负荷和耐受性都高于实际情况,理论上能完全杀灭微生物,足以满足无菌保证水平的要求,故没有必要对每一批次产品进行灭菌前微生物污染水平的监控。从控制热原的角度,建议按照药品 GMP 管理,以适当的频次对微生物污染水平进行监测。
与过度杀灭法相比,残存概率法的热能较低,为不降低产品的无菌保证水平,除了需要对灭菌过程本身进行严格的控制以外,还需要通过合理的工艺设计来降低微生物污染,并采用适当的方法对微生物污染水平和耐受性进行监测。
2.1 降低灭菌前微生物污染的工艺设计
在生产工艺各环节引入微生物的风险评估基础上,通常考虑采用药液过滤、药液存放时限控制等方法来降低注射剂灭菌前的微生物污染。虽然药液过滤在最终灭菌产品的生产中仅仅作为辅助的控制手段,但是在工艺研究过程中,也应该对滤膜的孔径、材质、使用周期等基本性质进行必要的筛选和验证,并在工艺操作中进行相应的规定。药液在制备、分装过程中易引起微生物繁殖,尤其一些营养型的注射剂,因此应通过必要的考察和验证来确定药液配制至过滤前、以及过滤、灌装后至灭菌前能够放置的最长时限,并相应确定产品的批量和生产周期。
2.2 灭菌前微生物污染的监测
灭菌前微生物污染水平监测的取样应覆盖正常生产的整个过程,应基于风险评估选取最有代表性的样品,且要充分考虑到产品从灌装到灭菌前的放置时间。如果灌装需要持续一段时间,通常从每批产品灌装开始、中间及结束时分别取样,也可根据风险评估结果选取合适的取样点进行取样。灭菌前微生物污染水平的监测方法应经过验证,具体操作可参照《中国药典》2020 年版四部通则1105“微生物计数法”和 1106“控制菌检查法”。
对于残存概率法灭菌前微生物污染水平监测中发现有污染菌的产品,应采用合适的方法进行污染菌的耐受性检查。一般来说,生物指示剂的耐受性用 DT 值(耐热参数)来表示。耐受性检查中任何幸存下来或生长的微生物都可以被假定为耐热菌,一般采用定时煮沸法将其与已知的生物指示剂的耐受性加以比较,必要时,可进一步测试耐热污染菌的 DT 值,DT 值的测定可以参考《中国药典》2020 年版四部通则9208“生物指示剂耐受性检查法指导原则”进行,然后根据灭菌的 F0 值、污染菌的数量与耐受性对产品的无菌性做出评价。当产品微生物污染水平超过限度时,应对污染菌进行鉴别,调查污染菌的来源并采用相应的纠正措施。
(二)湿热灭菌工艺的验证
湿热灭菌工艺的验证一般分为物理确认和生物学确认两部分,物理确认包括热分布试验、热穿透试验等,生物学确认主要是微生物挑战试验。物理确认和生物学确认结果应一致,两者不能相互替代。
1.物理确认
1.1 物理确认的前提
物理确认所用的温度测试系统应在验证和/或试验前、后进行校准,校准的频次应根据仪器设备的性能、验证持续的时间长短来确定。物理确认所涉及的灭菌设备,应该在灭菌工艺验证前已通过设备确认。
1.2 空载热分布试验
如果在实施灭菌工艺验证前已经在包含拟验证工艺条件下完成了空载热分布试验,且在验证合格期限内,原则上可以引用相关数据和结论。
1.3 装载热分布试验
装载热分布试验的目的是在拟采用的装载方式下,考察产品装载区内实际获得的灭菌条件与设计的灭菌周期工艺参数的符合性。了解装载区内的温度分布状况,包括高温点(热点)、低温点(冷点)的位置,为后续的评估和验证提供科学依据。装载热分布一般在空载热分布的基础上进行。温度探头的个数和安装位置应综合灭菌器的几何形状、空腔尺寸、产品排列方式以及空载热分布确认的结果等要素确定,且至少应涵盖空载热分布测试获得的高温点、低温点,灭菌器自身温度测试探头部位等特殊位置。温度探头在该阶段测试中应固定,且安放在待灭菌容器的周围,注意不能接触待灭菌容器或非常接近灭菌器内壁。
装载热分布试验需要考虑最大、最小和生产过程中典型装载量情况,试验时应尽可能使用待灭菌产品。如果采用类似物,应结合产品的热力学性质等进行适当的风险评估。待灭菌产品的装载方式和灭菌工艺等各项参数的设定应与正常生产时一致,应采用适宜的方式(图表或照片)描述产品的装载方式,并评估探头放置是否合理。每一装载方式的热分布试验需要至少连续进行三次。
1.4 热穿透试验
热穿透试验用于考察灭菌器和灭菌程序对待灭菌产品的适用性,目的是确认产品内部也能达到预定的灭菌温度、灭菌时间或 F0 值。一个好的灭菌器和灭菌程序,既要使所有待灭菌产品达到一定的F0 值,以保障产品的 SAL≤10-6,同时又不能使部分产品受热过度而造成产品中活性成分的降解,导致同一灭菌批次的产品出现质量不均一。
热穿透试验的温度探头的个数和安装位置可参考装载热分布设置,安装位置的确定应基于风险评估的原则,包括热分布试验确定的和其他可能的高温点和低温点、灭菌器温度探头附近、产品温度记录探头处等。除要求采用足够数量的温度探头外,还应将热穿透温度探头置于药液中最难或最迟达到灭菌温度的点、或 F0 值最低的点,即整个包装中最难灭菌的位置。对于小容量注射液,如果有数据支持或有证据表明将探头放在产品包装之外也能够反映出产品的灭菌程度,风险能够充分得到控制,也可以考虑将探头放在容器之外。
热穿透试验的步骤及要求与装载热分布试验基本相同,每一装载方式的热穿透试验也需要至少进行三次。通过热穿透试验可以确定在设定的灭菌程序下,灭菌器内各个位置的待灭菌产品是否能够到达设定的灭菌温度、灭菌时间或 F0 值。再结合灭菌前微生物污染水平的检测,可以确定灭菌器内各个位置的待灭菌产品是否能够达到预期的无菌保证水平。
对于 F0 值最大点位置的样品,由于其受热情况最为强烈,因此应评估该位置产品的稳定性情况,以进一步确认灭菌对于产品的稳定性没有影响。
1.4 热分布和热穿透试验数据的分析处理
在物理确认试验中,应确认关键和重要的运行参数并有相应的文件和记录。需要关注的主要参数可能包括:
- 保温阶段每个探头所测得温度的变化范围
- 保温阶段不同探头之间测得的温度差值
- 保温阶段探头测得的温度与设定温度之间的差值
- 升温阶段探头测得达到设定温度的最短及最长时间
- F0的最大值及最小值
- 灭菌结束时的最低F0值
- 保温阶段腔室的最低和最高温度
- 热穿透温度探头之间的最大温差或F0的变化范围
- 最长平衡时间
- 正常运行的探头数
以上参数的合格标准应结合灭菌条件、灭菌设备的特点以及产品的实际情况制定。通常情况下,热分布试验的保温阶段内温度波动应在±1.0℃之内,升、降温过程的温度波动可通过总体 F0 值来反映。如果温度或F0 值差别超过可接受范围(需要根据设备、产品等实际情况,依据风险评估拟定科学合理的接受范围),提示灭菌器的性能不符合要求、装载方式选择不当等,需要寻找原因并进行改进,重新进行验证。另外对于热敏感的药物,还应该控制灭菌器的升温和降温时间,以保证输入的热能控制在合理的范围内,不会对产品的热稳定性造成影响。
2.生物学确认
湿热灭菌工艺的微生物挑战试验是指将一定量已知 DT 值的耐热芽孢(生物指示剂)在设定的湿热灭菌条件下进行灭菌,以验证设定的灭菌工艺是否确实能使产品达到预定的无菌保证水平。生物指示剂被杀灭的程度,是评价一个灭菌程序有效性的直观指标。
2.1 生物指示剂选用的一般原则
生物指示剂的选用参照《中国药典》2020 年版四部通则9207“灭菌用生物指示剂指导原则”。针对具体的灭菌工艺和具 体的产品,还应注意所用的生物指示剂的耐受性应强于待灭菌产品中的污染菌。
湿热灭菌工艺常用的生物指示剂有以下几种,嗜热脂肪地芽孢杆菌,生孢梭菌、枯草芽孢杆菌等。对于采用过度杀灭法的灭菌程序,生物指示剂系统主要是嗜热脂肪地芽孢杆菌的芽孢,或其他D121°C 值大于 1 分钟的芽孢。残存概率法由于其热输入量比较低,因此在验证中使用的生物指示剂的耐受性可以小于嗜热脂肪地芽孢杆菌。
2.2 生物指示剂的使用和放置
实际验证过程中可以将生物指示剂接种到待灭菌产品中或直接使用市售的生物指示剂成品。由于生物指示剂在不同介质或环境中的耐受性会有所不同,所以无论是将生物指示剂接种到待灭菌产品的方法,或直接使用市售的生物指示剂成品,均应考虑待灭菌产品对细菌芽孢耐受性的影响,如果待灭菌产品会使芽孢的耐受性增加,应采用直接接种到待灭菌产品的方法。如果生物指示剂与产品不相容,可以用与产品相似的溶液来代替产品。使用市售生物指示剂时,应确保生物指示剂的 DT 值和总芽孢数等主要质量参数的准确性。
生物指示剂的接种量(即初始芽孢数)需要根据生物指示剂在待灭菌样品中的耐受性和灭菌工艺条件来确定,应符合挑战性试验的要求。生物指示剂的接种量可用附件 2 的方法计算。
生物指示剂的数量和放置位置应综合灭菌器的几何形状、空腔尺寸、产品的装载方式以及热分布确认的结果等要素确定,且在灭菌设备的冷点处必需放置生物指示剂。装有生物指示剂的容器应紧邻于装有测温探头的容器,直接接种供试品宜放置在热穿透试验产品的紧邻位置,灭菌器的其他部位应装载产品或者类似物,以尽可能的模仿实际生产时的状况。
2.3 灭菌
生物指示剂挑战试验应该按照产品设定的灭菌工艺进行灭菌。每个产品的每一灭菌程序,至少需要连续进行三次生物指示剂挑战试验。
2.4 检查和培养
可以根据生物指示剂的生长特性以及验证时的接种方式,采用适当的方法进行检查和培养。完成灭菌后,尽快将挑战指示剂放入培养基中进行培养。需要注意不同的生物指示剂所需要的培养条件也各不相同,建议参照所用生物指示剂的特性和供应商的说明书来选择培养条件,同时应放置阳性对照品和阴性对照品。
2.5 试验结果的评价
根据生物指示剂的 DT 值、接种量以及挑战试验验证结果,结合产品灭菌前微生物的污染水平(耐受性及微生物污染数量)来评价产品在验证的灭菌条件下实际达到的 SAL 值。如果验证结果出现不合格,需要分析原因,采取相应的改进措施后重新进行验证工作。
3.基于风险评估的验证方案设计
湿热灭菌工艺验证时,如存在不同灭菌器(一般指相同工作和设计原理的灭菌器)、处方组成、容器规格、装量、装载方式等情况。在不牺牲无菌保证水平的前提下,为减少验证试验数量,降低验证成本,可综合各方面因素考虑,在风险评估的基础上,通过充分的合理性论证,选用具有代表性的灭菌器、待灭菌产品和装载方式等进行灭菌工艺验证,可不必对所有情况进行验证。
三、注射剂无菌生产工艺
注射剂应首选终端灭菌工艺。如经充分的研究(包括处方工艺研究、质量控制研究等)证实产品无法耐受终端灭菌工艺,则可考虑能否通过除菌过滤工艺进行过滤除菌,如果可以,可采用包含除菌过滤的无菌工艺;如果不可以,则可考虑采用无菌分装的全无菌工艺。
(一)无菌生产工艺的研究
1.除菌过滤工艺的研究
除菌过滤是指采用物理截留的方法去除液体中的微生物,以达到无菌药品相关质量要求的过程。采用除菌过滤工艺时,工艺研究和生产过程控制的重点是影响无菌保证水平的工艺步骤和工艺参数,主要包括物料(如原料药、辅料、内包装材料等)的质量控制、除菌过滤系统的设计及选择、除菌过滤工艺参数的研究、除菌过滤生产过程的控制等。
通常,除菌级过滤器在工艺条件下每平方厘米有效过滤面积可以截留≥107CFU(colony forming unit,集落/菌落形成单位)的缺陷短波单胞菌(Brevundimonas diminuta,曾用名:缺陷假单胞菌)。除菌过滤工艺通常选用 0.22μm(更小孔径或相同过滤效力)的除菌级过滤器。
应尽可能采取措施降低除菌过滤的风险,例如:①宜安装第二只已灭菌的除菌过滤器,最终的除菌过滤器应当尽可能接近灌装点;②由于微生物通过除菌过滤器的概率随着待过滤药液中微生物数量的增加而增加,最终除菌过滤前,待过滤药液的微生物负荷一般小于等于 10cfu/100ml;③应通过研究确定药液配制后至过滤前的存放时间、药液过滤操作的时间、过滤后至灌装前放置的时间等工艺时限。
除菌过滤器的除菌过滤效能是评价除菌过滤工艺的重要参数,需要进行相应的研究和验证。通常,影响除菌过滤器的除菌过滤效能的因素包括:①药液的性质,如药液的粘度、表面张力、pH 值、渗透压等;②过滤步骤的工艺参数,如过滤的压力、流速、时间、温度等;③除菌过滤器与所过滤的药液的相互作用,如除菌过滤器与药液的相容性;④除菌过滤器预处理、过滤总量和使用周期等。除菌过滤器的过滤效能可因产品和操作条件不同而不同,滤器的选择及工艺参数的研究应考虑上述因素。
2.无菌分装工艺的研究
无菌分装工艺是指灭菌/除菌工艺处理后的原料药或者原料药和辅料,用无菌操作的方法分装到灭菌后的容器中再进行密封的生产工艺。无菌分装工艺的工艺研究和生产过程控制的重点同样是影响无菌保证水平的工艺步骤,主要包括物料(原料药、辅料、内包装材料等)的质量控制、物料暴露于环境中可能再污染的操作步骤等。
关于物料的质量控制,采用无菌分装工艺的制剂所涉及的所有物料,都必须采用适当的灭菌/除菌工艺处理后方可使用。各物料的灭菌/除菌工艺,都应经过验证、进行监测,并受到良好的控制。同时需要对各物料的无菌性、细菌内毒素水平等进行严格控制,通过研究确定相应的质控标准。
原料药或者原料药和辅料的分装步骤是影响产品质量和无菌保证水平的关键生产步骤,应结合生产设备和产品特点进行工艺参数(如分装速度和分装时间等)的研究,并确定相应的工艺控制标准。
(二)无菌生产工艺的验证
无菌生产工艺验证主要包括除菌过滤工艺验证及无菌工艺模拟试验。采用除菌过滤工艺的产品应进行除菌过滤工艺验证及无菌工艺模拟试验,采用无菌分装工艺的产品应进行无菌工艺模拟试验。
1.除菌过滤工艺验证
除菌过滤工艺验证一般包括细菌截留试验、化学兼容性试验、可提取物或浸出物试验、安全性评估和吸附评估等内容。应结合产品特点及实际过滤工艺中的最差条件,对相关验证试验进行合理设计,具体验证操作(如细菌截留试验中挑战用微生物的选择、滤膜的要求,可提取物和浸出物试验中的风险评估、提取方式、检测方法及安全性评估,化学兼容性试验中应重点考察的指标,吸附试验的试验条件等)可参照《除菌过滤技术及应用指南》及《化学药品注射剂生产所用的塑料组件系统相容性研究技术指南》相关内容进行。其中,结合产品特点,还应关注的内容如下:
1.1 细菌截留试验中挑战溶液的选择
药品和/或工艺条件本身可能会影响挑战微生物的存活力,因此在进行细菌截留试验之前,需要确认挑战微生物于工艺条件下在药品中的存活情况(生存性实验/活度实验),以确定合理的细菌挑战方法。对于非杀菌性/非抑菌性的药液,直接在药液中接种测试微生物是测试除菌级过滤器(滤膜)细菌截留能力的首选方法;对于抑菌的/杀菌的药液,可采用修改工艺(如调整温度)、修改测试液配方(调整 pH 值、去除杀菌成分或使用产品的替代溶液)等方法对过滤器(滤膜)进行预处理后再进行细菌挑战试验。如果使用替代溶液进行试验,需要提供合理的数据和解释。对于同一族产品,即具有相同组分而不同浓度的产品,可以用挑战极限浓度的方法进行验证,替代性地接受中间的浓度。
1.2 细菌截留试验条件的合理性
过滤温度、过滤时间、过滤批量和压差或流速等会影响细菌截留试验的结果。建议对实际生产的过滤工艺进行一次彻底评估,包括溶剂性质(例如水性的、酸、碱、有机的)、过滤时间、工艺压差、工艺流速、工艺温度、过滤批量和过滤系统设计规范,以便合理设计微生物截留试验条件。如果细菌截留验证研究中,在过滤器的下游检测到测试用微生物,则应进行调查。如果调查确认测试用微生物能穿透完整性检测达标的过滤器,那么就应重新考虑此种过滤器在这些工作条件下的适用性。
1.3 关于除菌过滤系统的完整性测试
完整性测试贯穿于细菌截留试验以及化学兼容性试验,除此之外,在药品连续三批生产工艺验证及常规生产过程中也涉及完整性测试。应明确过滤器使用后完整性测试的润湿介质(包括水、醇类溶液等标准介质或药液),如果采用的润湿介质为药液,则应进行产品相关完整性标准的验证以支持该标准的确定。
对于冗余过滤,使用后应先对主过滤器进行完整性测试,如果主过滤器完整性测试通过,则冗余过滤器不需要进行完整性测试;如果主过滤器完整性测试失败,则需要对冗余过滤器进行完整性测试。对于经过验证需要一系列(两个或以上)的除菌级过滤器的除菌单元,在使用后必须全部通过完整性测试。
1.4 关于滤器重复使用时的验证考虑
过滤器的重复使用对于制药过程来说是不被推荐的,如在实际工作中存在重复使用的情况,应进行充分的风险评估,包括细菌的穿透、过滤器完整性缺陷、可提取物的变化、清洗方法对产品内各组分清洗的适用性、产品存在的残留(或组分经灭菌后的衍生物)对下一批次产品质量风险的影响、过滤器过早堵塞、过滤器组件老化引起的性能改变等,并提供充分的验证和数据支持。
1.5 关于采用减菌过滤工艺时应进行的验证
减菌过滤通常设计在终端灭菌工艺生产的无菌制剂的灌装前端,或非最终灭菌工艺生产的无菌制剂的除菌过滤工序前端。
通常采用 0.45μm 或 0.22μm(及以下)孔径的过滤器。针对减菌过滤应进行的验证包括化学兼容性、可提取物/浸出物及吸附试验等。
2.无菌工艺模拟试验
无菌工艺模拟试验是指采用适当的培养基或其他介质,模拟制剂生产中无菌操作的全过程,评价该工艺无菌保障水平的一系列活动。应结合产品特点及实际工艺中的最差条件,对相关验证试验进行合理设计,具体验证操作,包括模拟介质的选择与评价(培养基、其他介质)、灌装数量及容器的装量、最差条件的选择、培养方式、结果评价等,可参照《无菌工艺模拟试验指南(无菌制剂)》相关内容进行。同时,应重点关注以下内容:
2.1 最差条件及干预操作的代表性
应结合产品实际生产工艺,评估模拟试验设计的最差条件及干预操作是否能够涵盖实际生产过程中可能产生的情况。最差条件并不是指人为创造的超出允许范围的生产状况和环境。为了确认无菌工艺风险控制的有效性,应通过风险评估并结合无菌生产工艺、设备装备水平、人员数量和干预等因素来设计模拟试验最差条件。包括但不限于以下方面:
1)人员:应充分考虑人员及其活动对无菌生产工艺带来的风险。如模拟生产过程的最多人数,当操作人员数量减少可能导致其他方面污染风险增加时,则此类条件也视为最差条件之一。参与人员应包括日常参与到无菌生产的全部人员,如生产操作、取样、环境监测和设备设施维护人员,同时应考虑以上人员交叉作业、班次轮换、更衣、夜班疲劳状态等因素。2)时限:在条件允许的情况下,适当考虑模拟实际生产操作过程中房间、设备、物料消毒或灭菌后放置的最长时间及最长的工艺保留时限等,如设备设施、分装容器、无菌器具灭菌后最长的放置时间等。3)灌装速度/分装速度:模拟试验应涵盖产品实际灌装速度范围,基于无菌风险的角度分析评价灌装速度对工艺过程及其他方面的影响程度。例如采用最慢的灌装速度、最大的容器用以模拟最长暴露时间;或采用最快的灌装速度、最小的容器时,用以模拟最大操作强度/难度。4)环境:无菌工艺模拟试验期间环境的消毒处理应依据正常生产期间的消毒方法进行,避免过度消毒及消毒剂的过度使用。
干预是指由操作人员按照相关规定参与无菌工艺生产的所有操作活动。干预可分为固有干预和纠正性干预。固有干预是指常规和有计划的无菌操作,如装载胶塞、环境监控、设备安装等;纠正性干预是指对无菌生产过程的纠正或调整,如生产过程中更换部件、设备故障排除等。
2.2 不同形式注射剂无菌工艺模拟试验
2.2.1 注射液
注射液通常采用培养基溶液进行常规的无菌工艺模拟试验。
2.2.2 注射用冻干粉末
注射用冻干粉末的无菌工艺模拟试验还包括冻干过程的进箱、冻干、出箱操作(冷冻可能会抑制微生物生长,通常不模拟冷冻过程),通常情况下可采用缩短维持时间模式,即培养基灌装到容器中,半压塞后将容器转移至冻干机内部分抽真空,维持时间短于实际冻干周期,然后箱体破空(可依据产品特性设计破空次数)后进行压塞。
2.2.3 注射用无菌粉末
注射用无菌粉末其分装所用的生产线与常规液体灌装线不同,进行无菌工艺模拟试验时需要将培养基及模拟介质均灌装入容器中,模拟方法通常包括:使用无菌粉末分装设备将液体培养基和模拟介质进行一步灌装;加装特殊设备灌装液体培养基;先在线灌装无菌液体培养基到容器中,然后再在生产线上进行无菌粉末的分装模拟;先在生产线上进行无菌粉末的分装,然后再灌装无菌液体培养基到容器中;或其他方式。应根据具体情况设计培养基灌装工艺,并充分说明设计的合理性。
四、附件
附件 1:注射剂灭菌工艺选择的决策树
附件 2:生物指示剂的接种量(即初始芽孢数)的计算方法
根据公式:
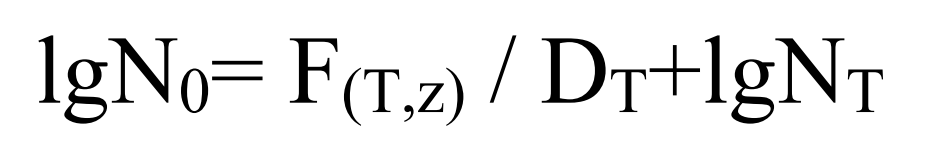
公式中,F(T,z)——在规定的温度系数(z 值)下,灭菌工艺期望获得的温度 T/℃下的等效灭菌时间,min;
DT——生物指示剂在温度 T/℃下的耐热参数,min;
N0——灭菌前生物指示剂的初始芽孢数;
NT——灭菌后生物指示剂的存活芽孢数;
一般在灭菌验证时,要求灭菌后所有生物指示剂为阴性结果(即全部杀灭),则 NT 实际能够达到10-1~10-2,甚至更低。但是,为了增加灭菌保障的安全边际,一般取 NT=1,即 lgNT =0。以上公式中,当生物指示剂确定后,其 DT 可确定,灭菌工艺确定后,所期望的灭菌值 F(T,z)可确定,lgNT 取 0,则可计算 N0。特殊情况下,若选取 NT<1 计算 N0,应提供合理性说明。
五、参考文献
[1]《中国药典》(2020 年版)中国医药科技出版社,2020.
[2] 国家药品监督管理局.关于发布除菌过滤技术及应用指南等3个指南的通告(2018 年第 85号)
[3] 药品生产质量管理规范(2010 年修订)(卫生部令第 79 号)
[4]《药品生产验证指南》化学工业出版社,2003.
[5] EU.GMPAnnex 1 : Manufacture of Sterile Products(2020).
[6] EMA.Guideline on the sterilisation of the medicinal product, active substance,excipient and primary container(2019).
[7] FDAGuidance for Industry Sterile Drug Products Produced by Aseptic Processing –Current Good Manufacturing Practice.
[8] PDAValidation of Moist Heat Sterilization Pr0cesses: Cycle Design, DevelopmentQualification and Ongoing Control Technical Report No. 1 (2007 Revision) ofPDA.
[9] PDAProcess Simulation Testing for Aseptically Filled Products echnical Report No.22 (2011 Revision) of PDA.
[10] PDAtechnical Report No. 44 Quality risk management for aseptic processes(2008).
[11] PDASterilizing Filtration of Liquids Report No. 26 (2008 Revision) of PDA.
[12] WHOgood manufacturing practices for pharmaceutical products: main principles.
[13] ISO11138-1 Sterilization of health care products- Biological indicators- Part1:General requirements.
[14] ISO11138-3 Sterilization of health care products- Biological indicators- Part 3:Biological indicator for moist heat sterilization processes.







